Alles Materielle ist chemischer Natur, alles reagiert-
auf dieser oder
jener Zeitskala.
 1. Wie laufen chemische Reaktionen ab?
1. Wie laufen chemische Reaktionen ab?
Thermodynamik:
1. Hauptsatz: Die Gesamtenergie des Universums ist konstant.
2. Hauptsatz: Die Gesamtentropie des Universums nimmt stets zu.
Das bedeutet, das chemische Reaktionen immer dann spontan ablaufen,
wenn die Energie (sprich Enthalpie H) abnimmt und die Entropie (sprich
Unordnung S) zunimmt. Man kann damit eine neue Größe definieren, die
freie Energie G (Gleichung 1).
Da die Absolutwerte dieser Größen nicht bekannt sind, betrachtet man
praktischer Weise ihre Änderung (Gleichung 2).
Daraus resultiert die Tatsache, daß alle Reaktionen, bei denen die
freie Energie ΔGo abnimmt, spontan und
freiwillig ablaufen sollten.
Betrachten wir einigen Reaktionen:
1. Die Chlor- Knallgas- Reaktion
Setzt man ein Gemisch aus Wasserstoff und Chlor dem Licht aus, so
erfolgt die Reaktion entsprechend obiger Gleichung spontan und
expolsionsartig. Die Ausgangsstoffe sind nach erfolgter Reaktion kaum
mehr nachweisbar. Im Dunklen kann man das Germisch beider Gase jedoch
nahezu unbegrenzt aufbewahren, ohne das ein merklicher Umsatz zu
Chlorwasserstoff erfolgt.
2. Die Knallgas- Reaktion
Bei dieser Reaktion sind die Verhältnisse ähnlich! Jedoch benötigt man
statt Licht entweder Wärme (z. B. Ein Streichholz) oder eine
Katalysator.
3. Zerfall von Stickoxyd
Unter energetischen Gesichtspunkten sollte auch der Zerfall von
Stickoxyd NO in die Elemente energetisch begünstigt sein.
Leider ist das nicht so, sonst würde es mit dem Smog (Los-Angeles Typ)
nicht so schlimm aussehen. Der Zerfall in die Elemente findet zwar
statt, aber sehr langsam. Mit Hilfe eines Katalysators läßt sich der
Zerfall beschleunigen, was unter anderem beim Drei-Wege-Katalysator von
Autos ausgenutzt wird
4. Ammoniaksynthese
Diese Reaktion läuft bei Raumtemperatur zwar nahezu vollständig ab,
jedoch nur sehr langsam. Erhöht man hier die Temperatur, so läuft die
Reaktion jetzt zwar schneller ab, jedoch verbleiben dadurch mehr
Ausgangsstoffe im Reaktionsgemisch.
Aus dem Besprochenem resultieren 2 Tatsachen von enormer Wichtigkeit:
* Nicht alle chemischen Reaktionen laufen vollständig ab.
* Manche Reaktionen, die unter energetischen Gesichtspunkten günstig
sind und daher freiwillig ablaufen sollten, laufen nur sehr langsam
oder überhaupt nicht ab.
In diesem Kurs werden wir uns hauptsächlich mit der 1. Tatsache und
ihren Hintergründen beschäftigen.
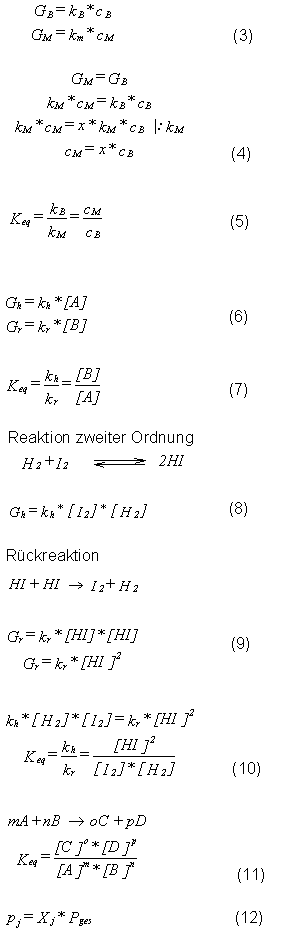 Das Holzapfel- Gleichgewicht
Das Holzapfel- Gleichgewicht
Ausgangslage:
Auf der Mitte zwischen 2 Grundstücken steht ein Holzapfelbaum, der
natürlich Holzäpfel verliert. Auf dem einen Grundstück wohnt ein alter
Mann m, auf dem anderen eine Familien mit einem jungen Burschen b.
Eines Tages bekommt der Junge den Auftrag das familiäre Grundstück von
Holzäpfeln zu säubern. Er merkt dabei recht schnell, das dies am
einfachsten dadurch zu bewerkstelligen ist, daß er die Holzäpfel auf
das Grundstück des alten Mannes wirft. Der alte Mann jedoch bemerkt
diesen Frevel und beginnt nun seinerseits die Äpfel zurückzuwerfen.
Wie endet der Konflikt? Auf dem ersten Blick erscheint es so!
Treffen wir eine erste Definition (Gleichung 3).
G ist dabei die Geschwindigkeit in [Äpfel/s], mit der die Äpfel von der
jeweiligen Person über den Zaun geworfen werden.
Daraus folgt, daß der Junge am Anfang die Äpfel schnell über den Zaun
werfen wird, der alte Mann jedoch langsam, wenn man davon ausgeht, daß
die Behendigkeitskonstante kM < kB
[m2/s] ist. Das hat zur Folge, daß die
Konzentration an Äpfeln cB in Äpfel/m2
sinkt, während cM zunimmt (womit auch GM
steigt)!
Zum Schluß erreicht man dann einen Punkt, an dem gilt GB
= GM.Setzt man vorraus, das kB=
x* kM ist, so folgt Gleichung 4.
Folglich ist das Erreichen dieses Gleichgewichtes nicht von der
Ausgangskonzentration an Äpfel abhängig! In dieser Situation gilt
Gleichung 5.
Dabei beschreibt die Konstante Keq den Zustand
des Gleichgewichtes und heißt daher auch Gleichgewichtskonstante .
Übertragen wir das ganze auf die chemische Ebene und betrachten
folgende Reaktion:
A ----> B
Es gilt dabei auf molekularer Ebene folgender Grundsatz: Wenn A
Moleküle in B umgewandelt werden können, so können auch B Moleküle in A
umgewandelt werden. Auf molekularer Ebene sind chemische Reakktion
reversibel. Daraus folgt, das unser Prozeß aus 2 Teilprozessen besteht:
A ----> B kh Geschwindigkeitskonstante
der Hinreaktion
B ----> A kr Geschwindigkeitskonstante
der Rückreaktion
Sind [A] und [B] die Konzentrationen der Moleküle A und B in mol/l, so
können wir die Reaktionsgeschwindigkeiten beider Teilreaktionen wie in
den Gleichungen 6 beschreiben.
Befindet sich die Reaktion nun im chemischen Gleichgewicht, so können
wir wiederum eine Gleichgewichtskonstante definieren (Gleichung 7).
Das bedeutet, daß im chemischen Gleichgewicht genausoviel B aus A
gebildet wird, wie B zu A zerfällt.
Die Reaktion von A zu B (bzw. umgekehrt) ist eine Reaktion erster
Ordnung, d. h. aus einem Molekül A wird ein Molekül B. Die meisten
chemischen Reaktionen sind jedoch komplexer. Wir wollen uns daher
einmal ein Beispiel für eine Reaktion 2. Ordnung ansehen.
Voraussetzung der Betrachtungen ist, daß ein Zusammenstoß eine H2
und eines I2-
Moleküls mit der richtigen Energie zur Reaktion führt. Unter dieser
Voraussetzung solte eine Verdopplung der Konzentration an Jod oder
Wasserstoff zu einer Verdopplung der Reaktionsgeschwindigkeit führen,
da die Anzahl der Kollisionen sich verdoppelt.
Die Geschwindigkeit der Hinreaktion ist somit gegeben durch Gleichung
8.
Wird die Geschwindigkeit in mol*s-1 und die
Konzentration in mol*l-1 gemessen, so ergibt
sich für die Geschwindigkeitskonstante kh als
Einheit l2*mol-1*s-1.
Betrachten wir nun die Rückreaktion. Sie erfolgt so, daß durch einen
Zusammenstoß zweier HI- Moleküle der Zerfall in I2
und H2 realisiert wird.
Die Reaktionsgeschwindigkeit hängt also von der Häufigkeit der
Zusammenstöße und somit von der Konzentration an HI ab. Daher handelt
es sich auch bei der Rückreaktion um eine Reaktion 2. Ordnung für deren
Geschwindigkeit Gleichung 9 gilt. Im Gleichgewicht heben sich die
Geschwindigkeiten von Hin- und Rückreaktion gerade auf, so daß
Gleichung 10 gilt.
Der so beschriebene Zusammenhang ist auch als Massenwirkungsgesezt
bekannt. Im vorliegenden Fall ist Keq daher die Gleichgewichtskonstante
det Reaktion von Jod und Wasserstoff zu Jodwasserstoff und es besagt,
das die konzentration von Produkten und Edukten im Gleichgewicht
unabhängig von den Ausgangskonzentrationen ist. Weiterhin ist es
gleichgültig, von welcher Seite man sich dem Gleichgewicht nähert und
in welchem Verhältnis die Ausgangskonzentrationen stehen.
In etwas allgemeinerer Form kann man auch Gleichung 11 schreiben.
Die Konzentrationen können in jeder Einheit gemessen werden, jedoch
werden üblicherweise folgende Einheiten benutzt:
1. Für Flüssigkeiten benutzt man die Molarität bzw. Mol/Liter, cj
- Das wird bei der Gleichgewichtskonstant durch ein
tiefgestellte c vermerkt (KC).
2. Bei Gasen benutzt man entweder die Molenbruch Xj
(KX) oder die Partialdrücke pj
(Kp).
Dabei gelten folgende Definitionen:
Der Molenbruch Xj einer Komponente j einer
Gasmischung ist gleich der Stoffmenge nj des
Gases j dividiert durch die Summe der Stoffmengen aller Gase der
betrachteten Mischung.
Den Partialdruck des eines Gases kann man wie folgt beschreiben: In
einem Gasgemsich bewgt sich jedes Gas- Molekül unabhängig. D. h. das
sich jedes Gas der Mischung so verhält, als würde es das gesamte
Volumen allein einnehmen. Beispiel: Ist jedes vierte Molekül einer
Gasmischung ein Sauerstoffmolekül und betragt der Gesamtdruck 1 bar, so
ist der Partialdruck des Sauerstoffs in dieser Mischung 0,25 bar.
Daraus folgt für pj Gleichung 12.
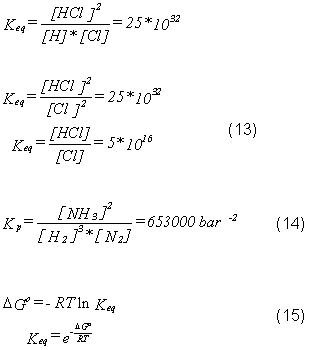 Beispiele chemischer Gleichgewichte
Beispiele chemischer Gleichgewichte
Betrachten wir jetzt noch einmal 2 der eingangs erwähnten Reaktionen
unter dem Aspekt des chemischen Gleichgewichtes näher.
A) Die Chlor- Knallgas Reaktion
Geht man von gleichen Ausgangskonzentrationen aus, so bleiben die
Konzentration beider Ausgangsstoffe gleich, da sie zu gleichen Anteilen
miteinander reagieren. Daher können wir unter diesen Bedingungen das
MWG entsprechend Gleichung 13 schreiben. Das bedeutet, daß im
chemischen Gleichgewicht 1 Molekül eines Ausgangsstoffes auf 50
Billiarden Produktmoleküle kommt.
In diesem Fall, dem Fall einer einheitslosen Gleichgewichtskonstante
spielen die Einheiten der Konzentration keine Rolle!
B) Die Ammoniaksynthese
Für die Gleichgewichtskonstante (bezüglich der Partialdrücke ) gilt
dann Gleichung 14.
Als erstes bemerkt man, daß die Gleichgewichtskonstante nicht
einheitslos ist und daher bei Verwendung andere Einheiten zur
Konzentrationsangabe auch andere Werte erhalten werden. Weiterhin ist
der numerische Werte nun nicht mehr so groß, was bedeutet, daß nunmehr
größer Mengen Educte mit dem Produkt im Gleichgewicht befindlich sind.
Beeinflussung des chemischen Gleichgewichtes
Aus der Kenntnis des MWG lassen sich nun einige Regeln zur
Beeinflussung des chemischen Gleichgewichtes ableiten.
1. Die einfachste Methode besteht darin, ein anfallendes Produkt sofort
aus der Reaktionsmischung zu entfernen. Bei der Ammoniaksynthese kann
man zum Beispiel den anfallenden Ammoniak durch einen Wasserstrahl
auswaschen. Auf diese Art und Weise kann das System den
Gleichgewichtszustand nicht erreichen, obwohl es bestrebt ist, dies zu
tun. Das gleiche Resultat erhält man, wenn z. B. Ein Produkt aus der
Reaktionsmischung ausfällt.
2. Ändert sich die Gesamtmolzahl der an einer Reaktion beeteiligten
Gase, so kann man durch eine Druckänderung eine Verschiebung des
Gleichgewichtes erzielen. Am Beispiel der Ammoniaksynthese läßt sich
dies wiederum gut demonstrieren:
Verdoppelt man den Druck auf das Reaktionsgefäß, so verdoppelt man auch
die Partialdrücke der Gase in der Reaktionsmischung. Das hat zur Folge,
das daß Verhältnis der Partialdrücke entsprechend dem MWG (22 / (23*2))
auf ein Viertel von Kp sinken würde. Zum Ausgleich dieser Störung
müssen also weiteres N2 und H2
miteinander reagieren, bis der Wert von Kp wieder erreicht ist. Daraus
folgt, daß eine Druckerhöhung die Reaktion in die Richtung verschiebt,
in der die Molzahl der Gase abnimmt.
Daraus kann man ein für chemische Gleichgewichte allgemeingültiges
Prinzip ableiten, daß Prinzip von Le Chatelier:
Wenn auf ein System im Gleichgewicht ein Zwang ausgeübt wird, dann
ändern sich die Gleichgewichtsbedingungen so, daß das System dem Zwang
ausweicht.
3. Der Einfluß der Temperatur ist auch vorhanden, wenn auch etwas
komplexerer Natur. Eine Temperaturänderung wirkt sich nämlich auf die
Geschwindigkeitskonstanten der Hin- bzw. Rückreaktion aus und damit
wird auch der Wert von Keq verändert.
Nach dem Prinzip von Le Chatelier führt also eine Temperaturerhöhung
zur Begünstigung der Reaktion, die Wärme verbraucht (Zerfall des
Ammoniaks in die Elemente). Temperaturerniedrigung begünstigt
entsprechend die exotherme Reaktion.
Es gibt einen Zusammenhang zwischen der freien Standardenergie und der
Gleichgewichtskonstanten zu geben. Mit Hilfe der Thermodynamik läßt
sich folgender Zusammenhang ableiten (Gleichung 15).
Damit ist auch der Weg zur experimentellen Bestimmung von
Gleichgewichtskonstanten geklärt, man bestimmt heute i. A. Den Wert der
freien Standardenergie und kann daraus dann den Wert der
Gleichgewichtskonstanten bestimmen.
 1. Wie laufen chemische Reaktionen ab?
1. Wie laufen chemische Reaktionen ab?  Das Holzapfel- Gleichgewicht
Das Holzapfel- Gleichgewicht Beispiele chemischer Gleichgewichte
Beispiele chemischer Gleichgewichte