Komplexbildung
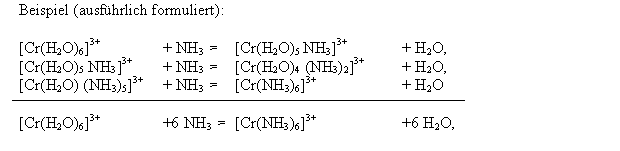 Bei
Komplexbildungen in wäßriger Lösung, bei denen also ein Metallion das
Zentralteilchen bildet, ist zu beachten, daß die Metallionen nicht
isoliert, sondern als Aquoionen vorliegen.Im allgemeinen werden sie
jedoch als Mx und nicht als M(H2O)nx formuliert. Ihre
Komplexbildungstendez hängt daher nicht nur von den Eigenschaften des
Zentralatoms, sondern auch der Liganden ab. Daher ist es nicht möglich,
eine universelle Reihe des Komplexbildungsvermögens aufzustellen.
Bei
Komplexbildungen in wäßriger Lösung, bei denen also ein Metallion das
Zentralteilchen bildet, ist zu beachten, daß die Metallionen nicht
isoliert, sondern als Aquoionen vorliegen.Im allgemeinen werden sie
jedoch als Mx und nicht als M(H2O)nx formuliert. Ihre
Komplexbildungstendez hängt daher nicht nur von den Eigenschaften des
Zentralatoms, sondern auch der Liganden ab. Daher ist es nicht möglich,
eine universelle Reihe des Komplexbildungsvermögens aufzustellen.
Komplexbildung mit einzähnigen Liganden
Neutrale Moleküle mit einem Donoratom werden als einzähnige
Neutralliganden bezeichnet. Der einfachste Neutralligand ist
Wasserstoff.
Man sieht an dem rechts formulierten Beispiel, daß es sich bei dieser
Komplexbildungsreaktion um eine Substitutionsreaktion handelt, bei der
der Ligand Wasser gegen Ammoniak ausgetauscht wird. Weiterhin sieht
man, daß die Reaktion stufenweise über die gemischten Komplexe abläuft.
Bei solchen Komplexbildungsreakktionen können Nebenreaktionen
auftreten, wie z.B. die Protolyse des Ammoniaks im vorliegenden Fall.
Liganden, die als Anionen in einen Komplex eintreten, werden auch als
Acidoliganden bezeichnet. Die Halogenwasserstoffsäuren bilden Fluoro-,
Chloro-, Bromo- bzw. Iodokomplexe. Die Bildung dieser Komplexe ist
wegen der geringen Basenstärke der Anionen nur gering pH-abhängig.
Cyanokomplexe bilden sich dagegen bevorzugt in neutraler bzw. basischer
Lösung.
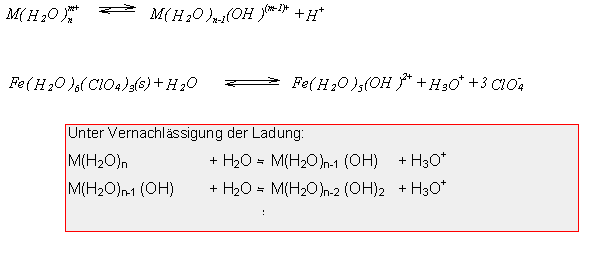
In diese Gruppe der Komplexe gehören auch die Hydroxokomplexe, deren
Bildung aus den Aquokomplexen wie rechts aufgeführt, beschrieben werden
kann.
Diese Reaktion erfolgt also bei Anwesenheit eines Protonenakzeptors als
Protolysereaktion. Als Protonenakzeptor können dabei freie
Wassermoleküle fungieren, da koordiniertes Wasser eine stärkere Säure
darstellt als nichtkoordiniertes.
Konsequenz: Beim Auflösen von stark hydratisierten, kristallinen Salzen
mehrwertiger Kationen tritt eine deutliche Erniedrigung des pH- Wertes
ein (siehe das rechts formulierte Beispiel).
Durch eine Erhöhung des pH-Wertes (z.B. durch Zugabe von
Natronlauge)erhält man dann eine ähnlich Reihe wie bei den
Neutralliganden (siehe rechts).
Meistens kennt man die Anfangs- und die Endglieder solcher Ketten. Die
Zwischenglieder sind jedoch häufiger sehr viel komplizierter aufgebaut
(Mehrkernige Komplexe).
Komplexbildung mit mehrzähnigen Liganden
 Zur Erinnerung!
Zur Erinnerung!
Chelat: Wenn mehrzähnige Liganden ( Liganden die mehr als eine
Koordinationsstelle des Zentralteilchens besetzen) am gleichen
Zentralteilchen mehrereKoordinationsstellen besetzen, so entstehen
Ringe. Den Komplex bezeichnet man als Chelat oder Chelatkomplex, den
Ligand als Chelatbildner.
Die so entstehenden Teilchen können ebenfalls neutral, Anionen oder
Kationen sein. Neutralchelate werden auch als Innerkomplexe bezeichnet.
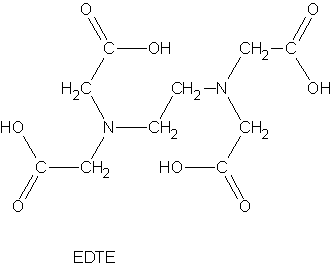
Als eine Gruppe von sehr wirksamen Chelatbildnern wurden die
Polyaminopolycarbonsäuren von Schwarzenbach gefunden. Der wichtigste
Vertreter diese Gruppe ist die Ethylendiamintetraessigsäure (EDTE).
EDTE ist ein sechszähniger Ligand der mit nahezu allen Metallionen
stabile Komplexe bilden kann. Das Dinatriumsalz wird als EDTA
bezeichnet.
Die Bildung von Mehrkernkomplexen
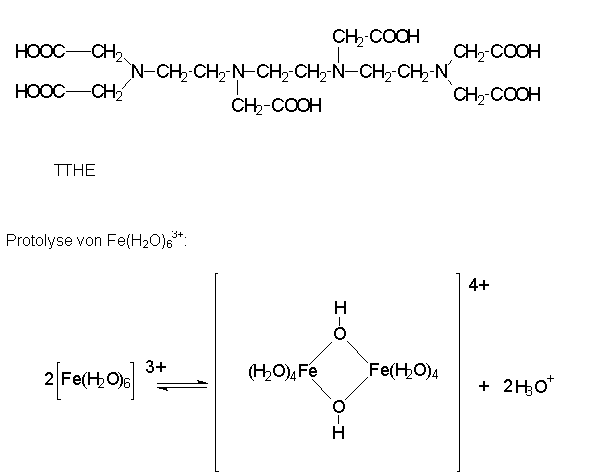 Komplexe,
die mehrere Zentralatome besitzen, werden Mehrkernkomplexe genannt. Die
Liganden, die Donaoratome mit mehreren freien Elektronenpaaren oder
andere Donoratome besitzen, wirken dabei als Brücke zwischen den
Metallzentren des Komplexes.
Komplexe,
die mehrere Zentralatome besitzen, werden Mehrkernkomplexe genannt. Die
Liganden, die Donaoratome mit mehreren freien Elektronenpaaren oder
andere Donoratome besitzen, wirken dabei als Brücke zwischen den
Metallzentren des Komplexes.
Ein besonders guter Komplexbildner is dabei die Triethylentetraminhexaessigsäure (TTHE), ein Ligand mit 10 Ligatoratomen!
Auch bei Metallaquoionen spielen Mehrkernkomplexe, wie schon erwähnt, eine große Rolle.
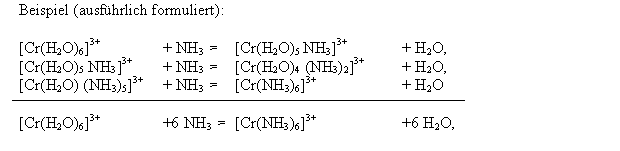 Bei
Komplexbildungen in wäßriger Lösung, bei denen also ein Metallion das
Zentralteilchen bildet, ist zu beachten, daß die Metallionen nicht
isoliert, sondern als Aquoionen vorliegen.Im allgemeinen werden sie
jedoch als Mx und nicht als M(H2O)nx formuliert. Ihre
Komplexbildungstendez hängt daher nicht nur von den Eigenschaften des
Zentralatoms, sondern auch der Liganden ab. Daher ist es nicht möglich,
eine universelle Reihe des Komplexbildungsvermögens aufzustellen.
Bei
Komplexbildungen in wäßriger Lösung, bei denen also ein Metallion das
Zentralteilchen bildet, ist zu beachten, daß die Metallionen nicht
isoliert, sondern als Aquoionen vorliegen.Im allgemeinen werden sie
jedoch als Mx und nicht als M(H2O)nx formuliert. Ihre
Komplexbildungstendez hängt daher nicht nur von den Eigenschaften des
Zentralatoms, sondern auch der Liganden ab. Daher ist es nicht möglich,
eine universelle Reihe des Komplexbildungsvermögens aufzustellen. 
 Zur Erinnerung!
Zur Erinnerung! 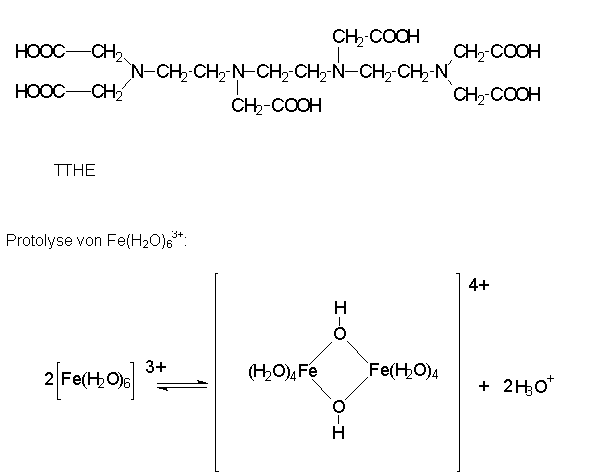 Komplexe,
die mehrere Zentralatome besitzen, werden Mehrkernkomplexe genannt. Die
Liganden, die Donaoratome mit mehreren freien Elektronenpaaren oder
andere Donoratome besitzen, wirken dabei als Brücke zwischen den
Metallzentren des Komplexes.
Komplexe,
die mehrere Zentralatome besitzen, werden Mehrkernkomplexe genannt. Die
Liganden, die Donaoratome mit mehreren freien Elektronenpaaren oder
andere Donoratome besitzen, wirken dabei als Brücke zwischen den
Metallzentren des Komplexes.