Die Stärke von Säuren und Basen in wäßriger Lösung
 Für
die Reaktion von HA mit Wasser läßt sich wiederum das MWG formulieren
(1). Im Falle verdünnter wäßriger Lösungen kann die Aktivität des
Wassers 1 gesetzt werden, daraus folgt für die Säurekonstante KS
entsprechend Gleichung (2).
Für
die Reaktion von HA mit Wasser läßt sich wiederum das MWG formulieren
(1). Im Falle verdünnter wäßriger Lösungen kann die Aktivität des
Wassers 1 gesetzt werden, daraus folgt für die Säurekonstante KS
entsprechend Gleichung (2).
Durch analoge Betrachtungen gelangt man zur Basekonstante KB entspechend Gleichung (3).
Auch bei diesen Konstanten benutzt man lieber ihren negativen
dekadischen Logarithmus und bezeichnet sie als pKS bzw. pKB- Werte.
Betrachten wir nun einmal ein korrespondierendes Säure-Base Paar.
Für die Säure- bzw. Basekonstante gelten die rechts argestelltenen Beziehungen.
Das bedeutet, daß das Produkt aus Säure- und Basekonstante gleich dem
Ionenprodukt des Wassers ist bzw. gilt pKS pKB = pKw = 14. Somit kann
man bei Kenntnis des pKS- Wertes den pKB-Wert der korrespondierenden
Base ermitteln und umgekehrt. Weiterhin folgt daraus, daß zu einer
starken Säure eine schwach protolysierende Base korrespondiert und zu
einer schwachen Säure eine stark protolysierende Base. Für die
Unterteilung der Säurestärke gilt: 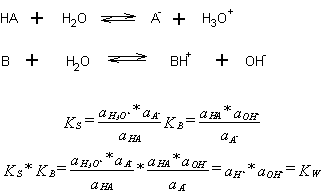
sehr starke Säuren
pKS < pKS(H3O ) = -1,74
starke Säuren
-1,74 < pKS < 4,5
mittelstarke Säuren
4,5 < pKS < 9,5
schwache Säuren
9,5 < pKS <15,74
sehr schwache Säuren
pKS > pKS(H2O) = 15,74
Sehr starke Säuren wie z. B. die Salzsäure ( pKS ~ -6,0 ) protolysieren
daher in Wasser praktisch vollständig unter Bildung der schwächeren
Säure H3O und der korrespondierenden sehr schwachen Base Chlorid Cl-.
Das bedeutet das gleichkonzentrierte wäßriuge Lösungen sehr starker
Säuren unabhängig von ihrem pKS-Wert das gleiche Verhalten zeigen. Man
bezeichnet diesen Effekt auch als den nivellierenden Effekt des
Wassers. Diesen Effekt übt das Wasser natürlich auch auf alle sehr
starken Basen aus.
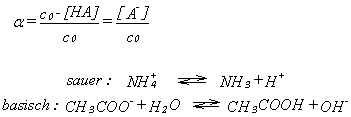 Der Protolysegrad alpha
Der Protolysegrad alpha
Mit sinkender Säurestärke, d.h. mit zunehmenden pKS- Wert, werden immer
mehr Anteile an nicht protolysierter Säure im Gleichgewicht verbleiben.
Bezeichnet man nun mit c0 die Ausgangskonzentration an Säure und mit
[HA] die Konzentration an undissozierter Säure im Gleichgewicht, so
giltfür den Protolysegrad alpha die rechts aufgeführte Formel.
Dabei gilt nämlich, c0 = [HA] [A-]!
Es lässt sich nun auch die Frage klären, warum reagieren einige
Salzlösung sauer bzw. basisch?(vgl. Reaktionsgleichungen rechts)
Für den Protolysegrad einer 1M Acetat- Lösung ergibt sich ein Wert von
alpha = 2,4 * 10-5, das bedeutet das 2,4*10-3% aller ursprunglich
vorhandenen Acetationen mit Wasser unter Protoneübertragung reagieren
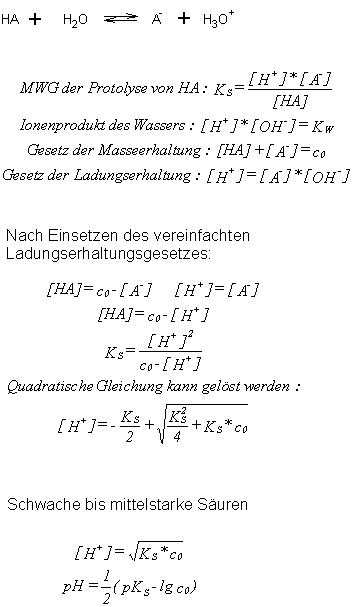 pH- Wert Berechnung
pH- Wert Berechnung
Im Protolysegleichgewicht einer Säure HA mit der Ausgangskonzentration
c0 treten vier Gleichgewichtskonzentrationen auf: [H ], [OH-], [HA] und
[A-]!
Weiterhin sind die rechts aufgeführten vier Gleichungen gültig. Wenn
man nun noch die durch die Autoprotolyse des Wassers gebildete
Konzentration an Wasserstoff- und Hydroxydionen vernachlässigt (dies
geht bis c010-6 mol*l-1), so gilt für das Gesetz der Ladungserhaltung
vereinfacht [A-] = [H ].
Nun kann man in das Massenwirkungsgesetz einsetzen, wie rechts demonstriert.
Die so erhaltene Gleichung ist für starke Säuren sinnvoll! Für schwache
bis mittelstarke Säure ist [H ] sehr viel kleiner als c0 und kann daher
im Nenner vernachlässigt werden. Es gilt in diesem Fall dann, der
rechts aufgelistete Fall.
 Für
die Reaktion von HA mit Wasser läßt sich wiederum das MWG formulieren
(1). Im Falle verdünnter wäßriger Lösungen kann die Aktivität des
Wassers 1 gesetzt werden, daraus folgt für die Säurekonstante KS
entsprechend Gleichung (2).
Für
die Reaktion von HA mit Wasser läßt sich wiederum das MWG formulieren
(1). Im Falle verdünnter wäßriger Lösungen kann die Aktivität des
Wassers 1 gesetzt werden, daraus folgt für die Säurekonstante KS
entsprechend Gleichung (2). 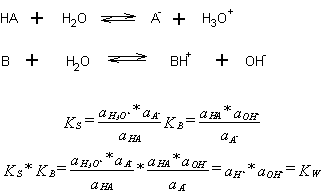
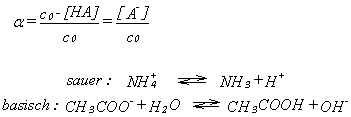 Der Protolysegrad alpha
Der Protolysegrad alpha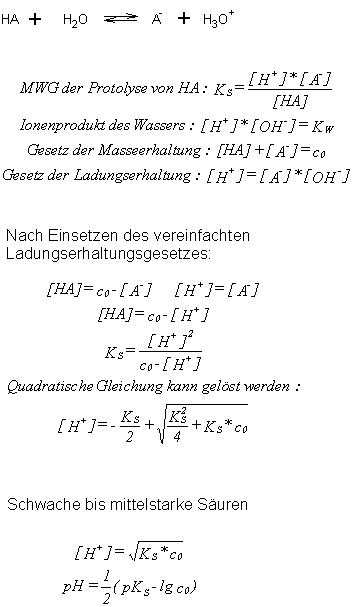 pH- Wert Berechnung
pH- Wert Berechnung