pH- Indikatoren
Wie aus beidem Abbildungen und der für pT abgeleiteten Formel
ersichtlich, wird der Äquivalenzpunkt für verschiedene Säuren (für
Basen gilt  adequat
pH =pT= 1/2(pKS -lg c0) bei unterschiedlichen pH-Werten erreicht. Daher
ist es notwendig, sowohl für Titration und i.A. für Suren/ Basen eine
Möglichkeit der pH- Wertbestimmung zu besitzen. Das geht einerseits auf
elektrochemischen Wege, z. B. durch Leitfähigkeitsmessungen (was hier
nicht besprochen werden soll) und andererseits durch pH- Indikatoren.
adequat
pH =pT= 1/2(pKS -lg c0) bei unterschiedlichen pH-Werten erreicht. Daher
ist es notwendig, sowohl für Titration und i.A. für Suren/ Basen eine
Möglichkeit der pH- Wertbestimmung zu besitzen. Das geht einerseits auf
elektrochemischen Wege, z. B. durch Leitfähigkeitsmessungen (was hier
nicht besprochen werden soll) und andererseits durch pH- Indikatoren.
Säure- Base Indikatoren sind organische Farbstoffe ( Azofarbstoffe,
Nitrophenole, Phtaleine ...), die selbst schwache Säuren oder Basen
sind und bei Protonierung bzw. Deprotonierung eine Farbänderung zeigen.
Generell gilt für 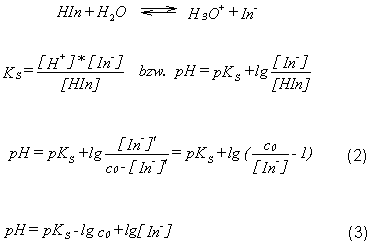 Indikatoren das rechts formulierte Gleichgewicht.
Indikatoren das rechts formulierte Gleichgewicht.
Umschlagspunkt zweifarbiger Indikatoren:
Annahme: Farbintensität beider Formen ist gleich.
Vorraussetzung: Das menschliche Auge nimmt eine Farbe dann als rein
wahr, wenn das Konzentrationsverhältniss beider Komponenten wenigstens
10 : 1 beträgt.
Für einen einfarbigen Indikator sehen die Verhältnisse anders aus! Hier
gibt es nur eine Konzentration, bei der man beginnt, die farbige
Komponente wahrzunehmen. Ist HIn farblos und die Indikatorbase In-
dagegen farbig, dann ist [In-]' die Konzentration, bei der die Farbe
sichtbar wird. Für den Umschlagspunkt des Indikators ergibt sich dann
Gleichung (2).
Da i. A. die Gesamtkonzentration an Indikator wesentlich größer als die
gerade beobachtbare Gesamtkonzentration [In-]' ist, gilt c0/[In-]'
>1, woraus Gleichung 3 folgt.
Das bedeutet, dass der Umschlagspunkt eines einfarbigen Indikators von dessen Gesamtkonzentration abhängt.
 adequat
pH =pT= 1/2(pKS -lg c0) bei unterschiedlichen pH-Werten erreicht. Daher
ist es notwendig, sowohl für Titration und i.A. für Suren/ Basen eine
Möglichkeit der pH- Wertbestimmung zu besitzen. Das geht einerseits auf
elektrochemischen Wege, z. B. durch Leitfähigkeitsmessungen (was hier
nicht besprochen werden soll) und andererseits durch pH- Indikatoren.
adequat
pH =pT= 1/2(pKS -lg c0) bei unterschiedlichen pH-Werten erreicht. Daher
ist es notwendig, sowohl für Titration und i.A. für Suren/ Basen eine
Möglichkeit der pH- Wertbestimmung zu besitzen. Das geht einerseits auf
elektrochemischen Wege, z. B. durch Leitfähigkeitsmessungen (was hier
nicht besprochen werden soll) und andererseits durch pH- Indikatoren. 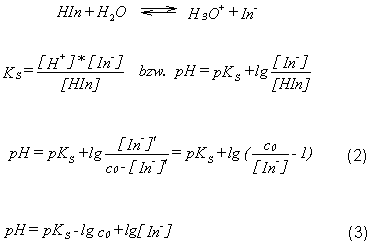 Indikatoren das rechts formulierte Gleichgewicht.
Indikatoren das rechts formulierte Gleichgewicht.