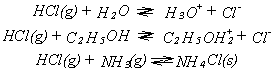 Säuren sind Moleküle oder Ionen, die Protonen abgeben können (Protonendonatoren).
Säuren sind Moleküle oder Ionen, die Protonen abgeben können (Protonendonatoren).| Säuren | Basen |
| Neutralsäuren (HNO3) | Neutralbasen (NH3) |
| Kationsäuren (NH4 ) | Kationbasen ( [Al(OH)(H2O)52 ] ) |
| Anionsäuren (HSO4-) | Anionbasen (HCO3-) |
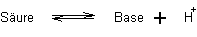
 Aus
der hier gegebenen Definition ergibt sich noch etwas anderes. Eine
Säure kann natürlich nur dann als Säure reagieren, wenn eine Base
vorhanden ist, die das Proton aufnimmt. Da sowohl Protonenaufnahme als
auch Protonenabgabe reversibel sind, stellt sich bei jeder Säure- Base
Reaktion ein Gleichgewicht ein (Protolysegleichgewicht). Durch die Lage
des Gleichgewichtes ist man in der Lage, Aussagen über die relative
Stärke der beteiligten Säure bzw. Base zu treffen.
Aus
der hier gegebenen Definition ergibt sich noch etwas anderes. Eine
Säure kann natürlich nur dann als Säure reagieren, wenn eine Base
vorhanden ist, die das Proton aufnimmt. Da sowohl Protonenaufnahme als
auch Protonenabgabe reversibel sind, stellt sich bei jeder Säure- Base
Reaktion ein Gleichgewicht ein (Protolysegleichgewicht). Durch die Lage
des Gleichgewichtes ist man in der Lage, Aussagen über die relative
Stärke der beteiligten Säure bzw. Base zu treffen.